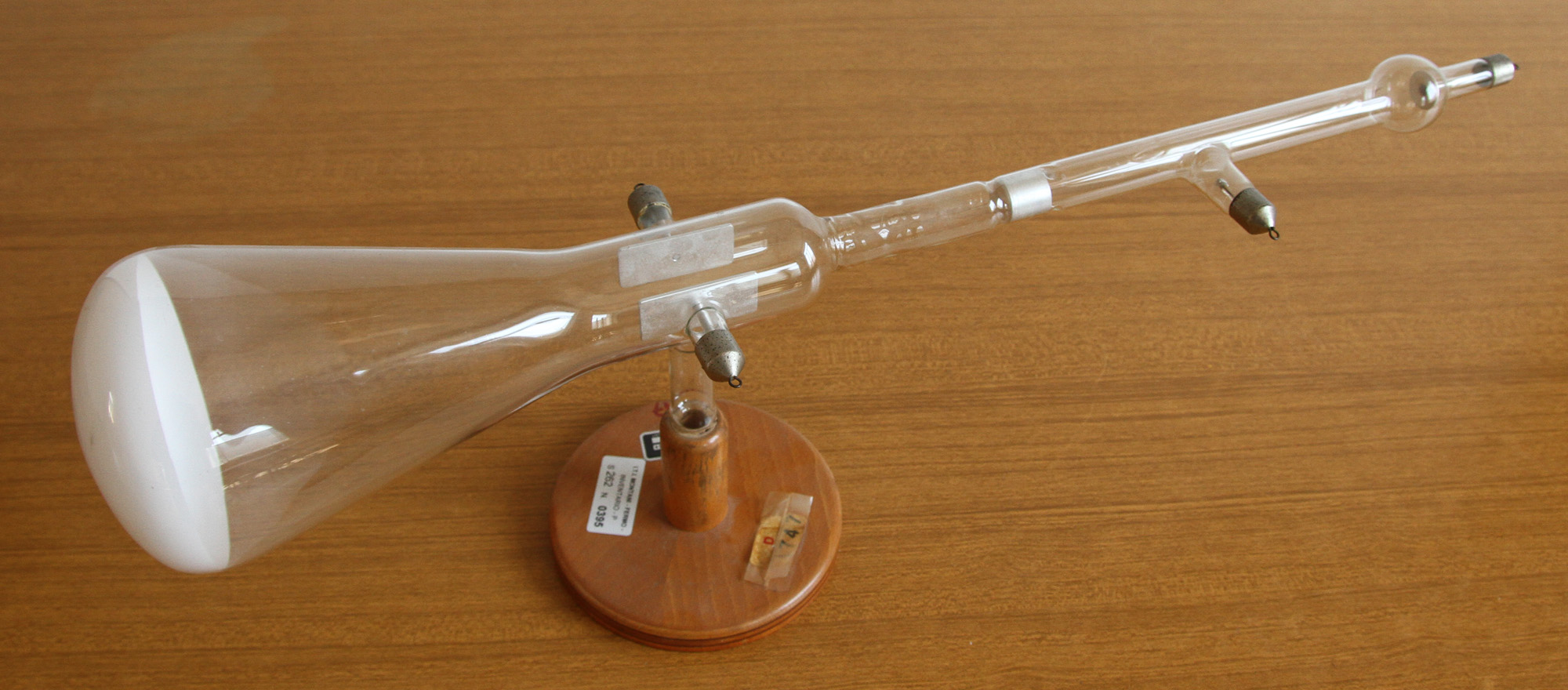

Tubo di Braun.
K. F. Braun (1850 – 1918) aveva costruito i suoi primi tubi fin dal 1897 modificando i tubi di Crookes per studiare i raggi catodici.
Nell`inventario del 1956 al n° 1747 si legge: “Tubo di Braun” e risulta acquistato il 25 marzo del 1960.
Destinato a Fisica, è stato usato per mostrare la deviazione degli elettroni dovuta la campo elettrico generato tra le due placchette di alluminio affacciate parallele ben visibili nelle foto.
Inoltre con questo tubo si poteva mostrare l`influenza di un campo magnetico sulla traiettoria degli elettroni sia usando un magnete permanente, sia un elettromagnete.
Il catodo è un disco di alluminio e l`emissione di elettroni avviene per effetto del bombardamento dei pochi ioni di gas positivi presenti.
L`anodo è posto di lato, ma gli elettroni, una volta accelerati dal forte campo elettrico esistente tra esso e il catodo, proseguono veloci verso le schermo.
Il tubo a vuoto presenta, dopo l`anodo e prima delle placchette, un cilindro di alluminio con alla base un foro per collimare il fascetto di elettroni che si dirigono verso lo schermo fluorescente di color bianco.
Nella zona dello schermo colpita dagli elettroni si osserva una macchia verde. In genere il color verde è tipico della fluorescenza del platinocianuro di bario.
Il tubo viene alimentato con un rocchetto di Ruhmkorff tra anodo e catodo, mentre il campo elettrostatico tra le placchette si ottiene collegandole ad una macchina elettrostatica di Wimshurst.
Oggi esperimenti di questo genere sono vietati poiché durante il loro svolgimento vengono emessi raggi X, pericolosi sia per chi opera nelle vicinanze sia per chi assiste.
Questo tubo è famoso nella storia della fisica poiché fu usato da J. J. Thomson che nel 1897 che, in tre articoli successivi, annunciò la prima scoperta di una particella elementare (in seguito chiamata elettrone).
J. J. Thomson (1865 – 1940) misurò il rapporto carica massa dell`elettrone applicando due campi, uno elettrico e uno magnetico, nella stessa zona ( dove sono le placchette) lungo la traiettoria degli elettroni.
I campi erano tali da generare due forze opposte su ciascun elettrone che attraversava la zona. Chiamiamo q la carica dell`elettrone, v la sua velocità, m la sua massa, E il campo elettrico, B il campo magnetico ed R il raggio di curvatura. Il campo elettrico uniforme tra le placchette genera una forza di intensità F = q E perpendicolare alla direzione della velocità dell`elettrone, che viene deflesso lungo un tratto di parabola. Il campo magnetico uniforme, generato da una coppia di bobine esterne al tubo, provoca una forza centripeta di valore F = q v B = m v²/R, sempre perpendicolare alla direzione dell`elettrone, che viene deflesso lungo un tratto di circonferenza. Il raggio R si trova misurando lo spostamento della macchia luminosa sullo schermo. Uguagliando sperimentalmente la forza elettrica e quella magnetica si ottiene q E = q v B da cui
v = E/B; sapendo che E = V/d, dove V è la d.di.p. tra le placchette e d è la distanza tra di esse, si ottiene
q/m = v/BR.
Per accertarsi che si trattasse sempre dello stesso tipo di particelle Thomson ripeté gli esperimenti molte volte: usando come catodo l`alluminio, provò dapprima con aria come gas residuo nel tubo, poi con idrogeno e ancora con anidride carbonica sempre molto rarefatti; usando come catodo il platino, provò con tracce di aria.
I risultati non molto accurati di Thomson, dovuti agli oggettivi limiti sperimentali, furono confortati da un altro suo esperimento, basato sulle misurazioni di energia termica ceduta allo schermo.
Vi furono poi risultati concordanti ottenuti da altri ricercatori con esperimenti di elettrolisi e infine va ricordato quello importantissimo di Millikan sulla misura della carica elementare.
Tutti confermarono che i cosiddetti “raggi catodici” erano formati da particelle cariche negativamente di massa circa 1800 volte più piccola degli ioni idrogeno e dello stesso valore di carica.
Per inciso va detto che il metodo di Thomson sulle misurazioni energetiche risultò più accurato, ma è didatticamente meno noto.
Nella foto in grigio si vede un tubo usato da J. J. Thomson contrassegnato col numero 19 106 che è riportato da entrambi i testi citati nella bibliografia.
Bibliografia:
Una esauriente spiegazione dell`esperimento di Thomson si trova in AA. VV., PPC Progetto Fisica, Vol. B, Zanichelli, Bologna 1986.
Una spiegazione decisamente più approfondita e dettagliata si trova in S. Weinberg, La scoperta delle particelle subatomiche, Zanichelli, Bologna 1986.
Foto di Federico Balilli, elaborazioni, ricerche e testo di Fabio Panfili.
Per ingrandire le immagini cliccare su di esse col tasto destro del mouse e scegliere tra le opzioni.


